聯系我們contact
電話(huà):027-59760188-801
地址:武漢市東湖高(gāo)新開發區(qū)光(guāng)谷大(dà)道120号現代森林(lín)小鎮A座609室
FDA和(hé)歐盟對(duì)計算(suàn)機系統審計追蹤要求的(de)比較與分(fēn)析
發布時(shí)間:2018-07-25 浏覽次數:362次
數據可(kě)靠性是監管機構當前關注的(de)熱(rè)門話(huà)題(1,2),而計算(suàn)機化(huà)系統審計追蹤是保障數據可(kě)靠性的(de)重要方面。FDA 21 CFR §11.10(a)小節對(duì)審計追蹤的(de)含義做(zuò)了(le)最初闡述,即系統識别已改變的(de)記錄的(de)能力。盡管主要法規在字面上均有關于審計追蹤需求應基于風險評估的(de)表述(3,4),而事實上審計追蹤已被作爲确保計算(suàn)機化(huà)系統數據可(kě)靠性的(de)強制要求,本文将對(duì)比歐盟(EU GMP Annex 11 (4))與 FDA(FDA 21 CFR 11 (5))關于計算(suàn)機化(huà)系統審計追蹤的(de)法規要求。
法規要求
因Part 11需結合相關基礎法規進行解釋,如GMP依據21 CFR 211 (6)而GLP依據21 CFR 58 (7),所以兩個(gè)法規之間的(de)對(duì)比略微有點複雜(zá)。爲便于對(duì)比,将這(zhè)兩個(gè)法規的(de)審計跟蹤内容拆分(fēn)爲若幹小條款分(fēn)别列舉在表1中,将含義基本一緻的(de)條款列舉在同一行中,有差異的(de)條款單獨列在一行。
初看表1中兩組法規要求的(de)對(duì)比,讀者可(kě)能認爲這(zhè)兩個(gè)法規不是很相似,這(zhè)可(kě)以理(lǐ)解。但是,通(tōng)過梳理(lǐ)這(zhè)兩個(gè)監管機構不同的(de)表述方法,我們可(kě)以确定這(zhè)兩個(gè)法規在大(dà)多(duō)數方面是相似的(de)。區(qū)别在于法規的(de)編寫方式:一個(gè)是明(míng)确詳述的(de)而另一個(gè)是解釋說明(míng)的(de)。下(xià)邊我們按表格中的(de)序号按順序逐條討(tǎo)論。
表一:FDA 21 CFR 11和(hé)歐盟Annex 11的(de)審計追蹤要求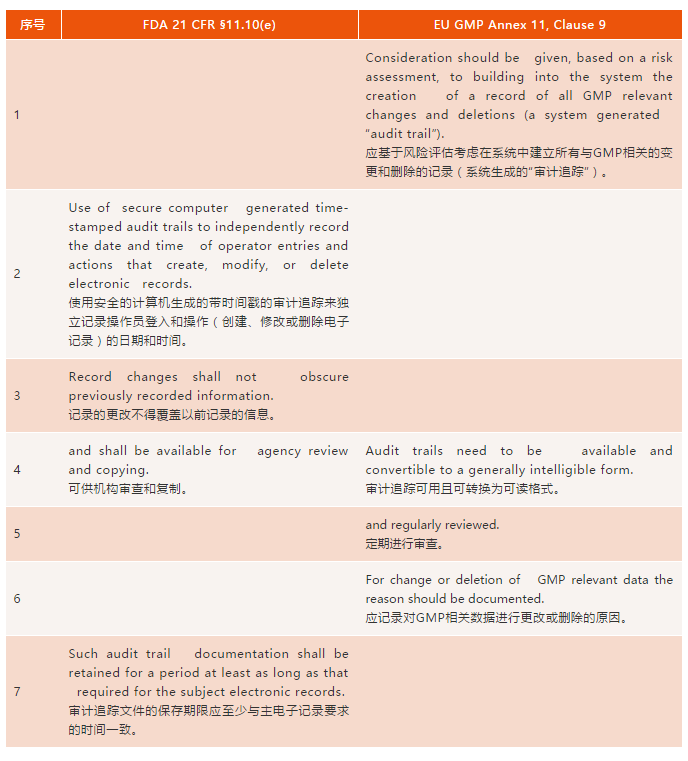
1條:Annex 11中對(duì)基于風險方法的(de)審計追蹤的(de)討(tǎo)論已涵蓋在Part 11範圍和(hé)應用(yòng)指南(nán)(3)中,因此兩個(gè)法規這(zhè)塊基本相同。
第2條:Part 11詳細介紹了(le)審計追蹤所需的(de)内容:安全的(de),帶時(shí)間戳的(de),計算(suàn)機生成的(de),以及監控記錄從創建到删除的(de)整個(gè)生命周期。此外,更改後産生的(de)新紀錄不得(de)覆蓋以前記錄的(de)數據。歐盟對(duì)審計追蹤的(de)要求沒有與之相對(duì)的(de)。然而,在Annex 11關于安全的(de)第12條下(xià),有如下(xià)要求:
12.4 Management systems for data and for documents should be designed to record the identity of operators entering, changing, confirming or deleting data including date and time. 12.4 對(duì)于數據和(hé)文件的(de)管理(lǐ)系統,應設計識别操作員(yuán)登入和(hé)操作(包括更改、确認或删除數據)的(de)日期和(hé)時(shí)間的(de)記錄。因此,要求是類似的(de),隻是Annex 11中并沒有集中體現在審計跟蹤章(zhāng)節。 |
第3條:Part 11中明(míng)确要求已記錄的(de)信息不能被覆蓋。Annex 11中沒有相應規定,但歐盟GMP中也(yě)有明(míng)确要求,詳見第4章(zhāng)(8)中,紙質、混合和(hé)電子系統的(de)良好記錄規範小節:
4.9 Any alteration made to the entry on a document should be signed and dated; the alteration should permit the reading of the original information. Where appropriate, the reason for the alteration should be recorded. 4.9 對(duì)文件記錄的(de)任何更改都應簽名并注明(míng)日期;改動後原始信息仍然可(kě)讀。在适當情況下(xià),應記錄更改的(de)原因。 |
第4條:兩個(gè)法規這(zhè)塊要求基本相同,都要求審計追蹤可(kě)供監管審查。歐盟多(duō)了(le)一條審計追蹤能以可(kě)讀格式導出的(de)要求,這(zhè)大(dà)概出于檢查員(yuán)的(de)審查需要。
第5條:乍一看Annex 11要求”定期審查”審計追蹤是Part 11與Annex 11之間的(de)主要區(qū)别。但是,情況真的(de)如此嗎?對(duì)于實驗室數據,§211.194(a) (6)中有第二人(rén)複核以确保實驗室記錄”完整”的(de)GMP要求,這(zhè)已經在一些483表格(9)和(hé)許多(duō)警告信(10,11)中解釋了(le),色譜數據系統中的(de)審計跟蹤也(yě)應進行審核。因此,兩個(gè)法規這(zhè)塊是相似的(de)。但目前實驗室應用(yòng)程序在記錄審計跟蹤複核狀态方面與法規要求還(hái)有差距,基本上所有實驗室軟件均不能以電子形式記載審計跟蹤複核信息。
第6條:Annex 11要求記錄進行更改時(shí)得(de)有原因,但Part 11中沒有相應内容;然而,更改原因的(de)要求應依從基礎适用(yòng)法規。在美(měi)國GMP中沒有要求更改記錄時(shí)需要原因(6),但是在GLP适用(yòng)法規§58.130(e)裏有要求:對(duì)自動化(huà)數據記錄的(de)任何更改都不應覆蓋原始記錄,應表明(míng)更改的(de)原因,注明(míng)日期,并标識責任人(rén)(7)。
第7條:Part 11提到審計追蹤的(de)保存期限要和(hé)适用(yòng)法規要求的(de)記錄保存期限一緻,而Annex 11中沒有明(míng)确聲明(míng)。但是,在歐盟GMP第4章(zhāng)第4.10-4.12條(8)可(kě)找到保存期限的(de)要求。
總結
本文對(duì)FDA 21 CFR 11和(hé)歐盟GMP Annex 11的(de)審計追蹤要求進行了(le)對(duì)比。總體來(lái)說,這(zhè)兩個(gè)具體的(de)法規雖然看似有差異,但FDA和(hé)歐盟在總體要求上是一緻的(de),有差異的(de)條款要麽體現在其它的(de)适用(yòng)法規中(針對(duì)21 CFR 11),要麽在其他(tā)章(zhāng)節中(針對(duì)歐盟GMP)。所以,在解讀法規的(de)特定章(zhāng)節時(shí),應注意到關聯法規或法規自身其它章(zhāng)節的(de)相互影(yǐng)響。另外,需要提醒一個(gè)容易忽略的(de)問題,多(duō)數商業應用(yòng)軟件不能充分(fēn)記錄審計追蹤複核的(de)信息,在審計跟蹤記錄發生更改時(shí)(如導出、歸檔等),需要做(zuò)好相應的(de)記錄。
參考文獻:
1. R.D. McDowall, Scientific Computing, August 2013
2. R.D. McDowall, Scientific Computing, September 2013
3. FDA Guidance for Industry, Part 11 Scope and Application, 2003
4. EU, Good Manufacturing Practice, Annex 11 Computerized Systems, 2011
5. Electronic Records; Electronic Signatures Final Rule 21 CFR 11, 1997
6. Current Good Manufacturing Practice for Finished Pharmaceutical Products, 21 CFR 211, 2008
7. Good Laboratory Practice for Non-Clinical Studies, 21 CFR 58, 1978
8. European Union, Good Manufacturing Practice, Chapter 4 Documentation, 2011
9. Able Laboratories, FDA 483 Observations, July 2005
10. Concord Laboratories, FDA Warning Letter, July 2006
11. Ohm Laboratories, FDA Warning Letter, December 2009

