聯系我們contact
電話(huà):027-59760188-801
地址:武漢市東湖高(gāo)新開發區(qū)光(guāng)谷大(dà)道120号現代森林(lín)小鎮A座609室
理(lǐ)解數據完整性
發布時(shí)間:2018-02-01 浏覽次數:352次
在保障電子記錄有效性方面我們之前討(tǎo)論了(le)數據訪問權限的(de)問題,其通(tōng)過身份認證和(hé)内容的(de)限制性訪問保證了(le)數據不受未經授權的(de)更改,但僅僅控制對(duì)電子記錄系統的(de)訪問并不能解決當前實驗室的(de)真正問題—數據完整性。我們依舊(jiù)以下(xià)面的(de)圖來(lái)開始話(huà)題。
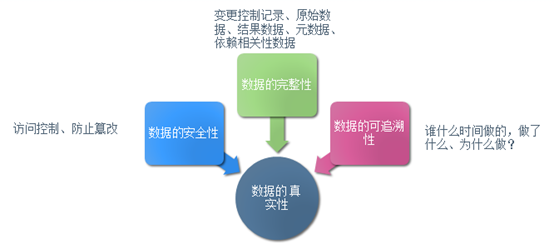
綜合FDA以及歐盟藥監機構對(duì)國内藥廠檢查情況來(lái)看,數據完整性缺失是出現頻(pín)次相當高(gāo)的(de)問題,綜合這(zhè)些Warning letter 來(lái)看,原始數據缺失(故意删除,覆蓋,丢失),分(fēn)析結果無法重現,方法修改不能追溯,原始數據與樣品無法關聯等,出現這(zhè)些問題的(de)原因與檢測實驗室人(rén)員(yuán)基本業務素質不高(gāo),粗心大(dà)意圖一時(shí)方便,無相關數據管理(lǐ)知識和(hé)理(lǐ)念不無關系。
數據完整性的(de)保證要基于兩方面的(de)知識,一個(gè)業務知識,另一方面是信息技術方面的(de)知識。彌補了(le)相關知識的(de)不足,對(duì)照(zhào)CFR Part11的(de)相關條款,就能清楚地了(le)解這(zhè)些都是水(shuǐ)到渠成,做(zuò)到深入理(lǐ)解而不是機械照(zhào)搬。
CFR Part11對(duì)電子記錄的(de)定義是指任何文本、圖表、數據、聲音(yīn)、圖示的(de)或其他(tā)的(de)以電子形式表現的(de)信息的(de)混合,它的(de)建立、修改、維護、歸檔、檢索或分(fēn)發是由計算(suàn)機系統來(lái)完成的(de)。按照(zhào)此定義,其清楚指明(míng)電子記錄就是所有在計算(suàn)機中創建和(hé)存儲的(de)數據。如果你打算(suàn)在受法規監管的(de)實驗室中使用(yòng)計算(suàn)機設備,其産生并存儲電子記錄,就必須以電子格式保留,更明(míng)确地說,如果一條記錄被認爲是原始記錄,就必須在可(kě)持續存儲設備上維護和(hé)歸檔,例如常見的(de)計算(suàn)機硬盤。我們不能拿一份儀器工作站導出的(de)紙質分(fēn)析報告去做(zuò)原始數據。
CFR Part11對(duì)數據完整性的(de)說明(míng)一筆帶過,十分(fēn)簡略,其在11.10b 作了(le)如下(xià)闡述:”系統應能對(duì)所有要求的(de)數據産生準确、完整的(de)可(kě)讀文檔和(hé)電子文檔,并且适合于FDA的(de)檢查、審核和(hé)複制。”相比而言,電子記錄的(de)審計跟蹤和(hé)數據安全性,以及電子簽名的(de)說明(míng)是十分(fēn)詳盡的(de)。在FDA和(hé)EDQM對(duì)國内藥廠的(de)檢查過程中,數據完整性卻又是常常出現問題的(de)所在。
衆多(duō)數據完整性問題發生的(de)單位對(duì)數據完整性的(de)理(lǐ)解比較片面導緻問題出現不知道如何去正确地糾正以及預防。
電子化(huà)的(de)數據分(fēn)爲四類,分(fēn)别是:原始數據、元數據、結果數據、審計跟蹤記錄。
原始數據是大(dà)家最熟悉的(de),所謂原始數據就是最直接的(de),根源的(de)數據。原始數據可(kě)以由以下(xià)方式産生(1)人(rén)工觀察紙質記錄,例如我們對(duì)實驗現象觀察後寫在實驗記錄本上的(de)描述性語言,或者是通(tōng)過早期的(de)打字機直接在紙張上将文字打印出來(lái),該打印出來(lái)的(de)紙張也(yě)是原始記錄(2)儀器,簡單設備通(tōng)過各種複雜(zá)的(de),參數可(kě)高(gāo)度配置化(huà)的(de)計算(suàn)機化(huà)系統産生的(de)圖譜,與人(rén)工記錄類似的(de)是儀器采集到數據後寫入到存儲介質上的(de)信号而不是紙上。關于原始數據的(de)認定,我們可(kě)以從儀器的(de)複雜(zá)性去考察。
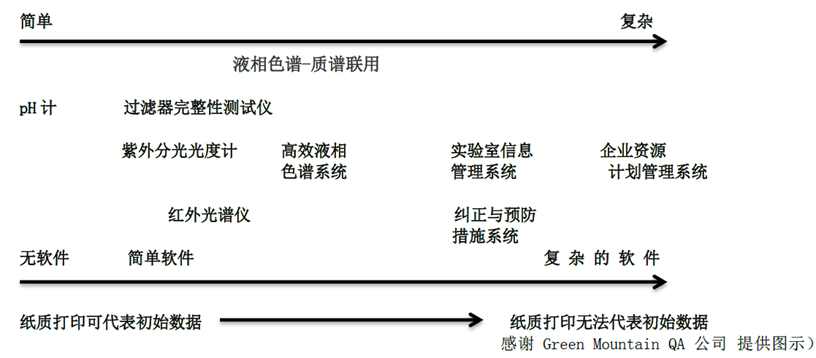
上圖表示的(de)是系統複雜(zá)性與可(kě)打印輸出作爲原始數據合理(lǐ)性的(de)關系。對(duì)于一些簡單系統(如pH計和(hé)天平)可(kě)能隻要求進行校正,很多(duō)天平可(kě)以直接在打印紙上輸出稱量結果,早期的(de)光(guāng)譜儀的(de)輸出也(yě)是在計量紙上直接打印輸出光(guāng)譜圖的(de),以上作爲原始數據是十分(fēn)合理(lǐ)的(de)。由于計算(suàn)機和(hé)儀器技術的(de)飛(fēi)速發展,現在的(de)光(guāng)譜儀往往配了(le)計算(suàn)機工作站,可(kě)調整的(de)參數也(yě)更多(duō)。而複雜(zá)系統則需要對(duì)其既定用(yòng)途進行驗證和(hé)确認。驗證與确認工作在圖中從左到右随著(zhe)系統複雜(zá)性增強而逐步增加,因爲儀器可(kě)配置性越高(gāo),其數據就越容易僞造和(hé)篡改。往右到了(le)色譜工作站,色譜數據系統(CDS)其可(kě)打印輸出就完全喪失了(le)作爲原始數據的(de)資格,即便打印出來(lái)并被分(fēn)析員(yuán)簽字的(de)報告也(yě)沒有資格作爲原始數據,這(zhè)是因爲被打印出來(lái)的(de)電子記錄通(tōng)常是不完整和(hé)不準确的(de),缺乏一些重要的(de)信息,如譜圖處理(lǐ)過程參數和(hé)審計日志。在對(duì)複雜(zá)系統計算(suàn)機驗證的(de)重視的(de)同時(shí)也(yě)不能忽略了(le)低複雜(zá)度系統。在這(zhè)些系統中,用(yòng)戶可(kě)以捏造數據或重複測試以達到所想要的(de)結果,而被發現的(de)機會較低(例如,獨立系統具有用(yòng)戶可(kě)設置參數的(de)輸出,例如,FT-IR,UV色譜儀)。
說到色譜圖的(de)過程處理(lǐ)參數,就要提到元數據。元數據就是關于數據的(de)數據。舉一個(gè)簡單的(de)元數據例子:對(duì)于一個(gè)Word文檔來(lái)說,除了(le)其包含的(de)内容作爲數據的(de)主體,與之相關的(de)還(hái)有文檔位置、文檔大(dà)小,文檔作者以及創建日期等信息,這(zhè)些信息就是這(zhè)篇文檔的(de)元數據。具體到分(fēn)析實驗室的(de)元數據,我們可(kě)以找出很多(duō)。針對(duì)一份樣品的(de)分(fēn)析原始數據,與之對(duì)應的(de)元數據包括分(fēn)析人(rén)員(yuán)、儀器運行過程控制參數、積分(fēn)參數,響應因子、校正數據、創建日期、文件位置,以及其對(duì)該原始記錄的(de)變更信息。沒有元數據就不可(kě)能重建用(yòng)原始輸入參數得(de)到原始結果的(de)過程,結果的(de)可(kě)追溯性就會受到限制。有了(le)以上的(de)知識,我們就能明(míng)白打印出的(de)報告并不會包含電子記錄的(de)所有數據,頂多(duō)隻能作爲臨時(shí)的(de)代表。總之,元數據是考察記錄是否可(kě)信并符合FDA要求的(de)關鍵。沒有元數據相佐證的(de)數據沒有任何意義。
電子數據中的(de)第三類結果數據或報告,可(kě)能在紙上,也(yě)可(kě)能保存在受控的(de)電子文檔管理(lǐ)系統中。所謂受控就是文檔的(de)提交,取出,編輯等對(duì)文檔的(de)變更操作系統均應有記錄,并且具有版本管理(lǐ)的(de)功能。結果和(hé)報告不是孤立存在的(de),還(hái)需要與其相關聯的(de)原始電子數據、數據發布或批準的(de)電子簽名,以及任何支撐結果報告的(de)紙質記錄建立有效鏈接,這(zhè)涉及本文中的(de)最後一個(gè)話(huà)題,後面再詳細說明(míng)。
電子數據中的(de)第三個(gè)内容是審計跟蹤記錄。全紙質記錄年代,當我們進行記錄的(de)修訂時(shí)就要求原來(lái)記錄隻能劃底線标志要删除,然後在空白處寫上變更内容,變更人(rén)、變更時(shí)間,這(zhè)可(kě)以稱得(de)上是紙質版的(de)變更記錄。在各個(gè)研發機構中,紙質版的(de)實驗記錄本一直就是其知識産權的(de)主要載體,管理(lǐ)良好的(de)規範化(huà)紙質記錄能作爲專利訴訟中的(de)重要證明(míng)材料。也(yě)正是應爲其敏感和(hé)重要,以及各國對(duì)電子化(huà)實驗記錄的(de)認可(kě)方面的(de)差異,這(zhè)一領域的(de)電子化(huà)過程步履艱難。采用(yòng)電子記錄,必然同樣要求有電子化(huà)的(de)變更記錄,在21CFRPart11中對(duì)審計跟蹤記錄做(zuò)了(le)十分(fēn)明(míng)确的(de)要求:”使用(yòng)安全的(de)、計算(suàn)機産生的(de)、時(shí)間标記的(de)審核跟蹤以便獨立地記錄操作者登錄和(hé)建立、修改、或删除電子記錄的(de)行爲的(de)日期和(hé)時(shí)間。記錄的(de)改變不能使先前的(de)記錄信息被覆蓋。”電子化(huà)的(de)審計跟蹤記錄可(kě)以不如紙版的(de)那麽清晰可(kě)見,但其要求一旦電子記錄創建,系統必須跟蹤所有修改(日期,時(shí)間,用(yòng)戶名,修改理(lǐ)由),審計跟蹤功不能被用(yòng)戶關閉,改變或删除。電子記錄的(de)審計跟蹤數據可(kě)以說是除安全性之後的(de)首要考慮因素,其是電子記錄可(kě)信的(de)必要條件。但審計跟蹤記錄隻是電子記錄變更管理(lǐ)的(de)一部分(fēn)内容,從Part11的(de)規定可(kě)看出其類似于操作日志,記錄的(de)是何人(rén)何時(shí)發生什(shén)麽操作,爲了(le)實現完整的(de)變更管理(lǐ),還(hái)需要系統擁有版本修訂控制功能,猶如Word中的(de)修訂功能一樣,可(kě)以記錄修訂前後的(de)值,組合起來(lái)就是何人(rén)何時(shí)将何對(duì)象從何值改爲何值。
除了(le)電子數據的(de)四個(gè)主要内容的(de)完整性外,我們還(hái)需要注意數據的(de)參考完整性。數據參考的(de)完整性即原始數據,元數據,結果報告之間的(de)關系要完整并且正确。如果各個(gè)數據單元間的(de)關系可(kě)以随意修改,那麽這(zhè)個(gè)數據網絡就很難管理(lǐ)了(le)。除了(le)上面提到的(de)結果報告與源數據關聯的(de)例子。在分(fēn)析實驗室我們還(hái)能舉出一些更加實際的(de)例子來(lái)。如果我們要對(duì)某個(gè)樣品Y進行主要成分(fēn)和(hé)雜(zá)質的(de)定量分(fēn)析,采用(yòng)的(de)方法A的(de)第二個(gè)版本A2。在Y 的(de)分(fēn)析前,已經做(zuò)好标準曲線,标準曲線涉及到标準品的(de)制備和(hé)後續的(de)數據拟合。當我們對(duì)樣品Y進行第一針的(de)分(fēn)析時(shí),由于色譜柱柱頭漏液導緻泵失壓,放棄分(fēn)析,此時(shí)系統産生對(duì)應樣品Y的(de)數據文件爲Y-1,在修複系統後,重新對(duì)Y進樣,此時(shí)應該産生數據文件Y-2,注意此處不應該将Y-1覆蓋。分(fēn)析完成後,按照(zhào)标準曲線對(duì)主成分(fēn)和(hé)雜(zá)質進行定量分(fēn)析,生成結果Y2-A2-1(此處僅爲代号)。至此,我們應該要求結果Y2-A2-1與原始數據Y2進行對(duì)應,原始數據Y2還(hái)應該與方法A的(de)第二個(gè)版本A2對(duì)應,相關的(de)标準曲線的(de)樣品原始數據和(hé)拟合結算(suàn)結果也(yě)應與結果Y2-A2-1形成關聯。更進一步,如果将來(lái)方法A發生了(le)修改形成了(le)新版本A3,當FDA來(lái)核查時(shí),也(yě)能查看到當日産生結果的(de)A3版方法的(de)參數。推而廣之,樣品測試期間的(de)儀器維護記錄也(yě)應該能準确找出。
凡本網文章(zhāng)除非特殊注明(míng),均屬于點風信息科技有限公司原創作品,未經本網授權不得(de)轉載、摘編或利用(yòng)其它方式進行商業化(huà)使用(yòng)。已獲本網授權的(de)作品,應在授權範圍内使用(yòng),并注明(míng)”來(lái)源:昆山九崴信息科技有限公司”。違者本網将追究相關法律責任。

