聯系我們contact
電話(huà):027-59760188-801
地址:武漢市東湖高(gāo)新開發區(qū)光(guāng)谷大(dà)道120号現代森林(lín)小鎮A座609室
SAP與LIMS之間的(de)集成簡述
發布時(shí)間:2018-07-04 浏覽次數:408次
SAP作爲企業資源管理(lǐ)解決方案中的(de)翹楚,不可(kě)謂不全面。但在實驗室的(de)資源管理(lǐ)領域,LIMS(實驗室信息管理(lǐ)系統)仍然以其專業性牢牢占據著(zhe)一席之地。在實驗室和(hé)生産部門之間,常常需要交換關于質量和(hé)分(fēn)析數據的(de)信息,因此将來(lái)自于實驗室的(de)産品質量信息整合到ERP中,從而更及時(shí)地處理(lǐ)産品放行/封存/重處理(lǐ)是十分(fēn)必要的(de)。下(xià)面談談LIMS與SAP QM,以及SAP MM模塊之間的(de)關聯關系。
● SAP QM(QM:質量管理(lǐ))和(hé)LIMS的(de)集成
模塊用(yòng)于對(duì)單個(gè)或一組産品創建檢驗計劃。基于檢驗計劃關聯的(de)取樣計劃的(de)要求,樣品必須注冊到LIMS系統中。這(zhè)組信息可(kě)下(xià)載到LIMS中,并創建符合取樣要求的(de)樣品。在制藥領域一個(gè)很大(dà)的(de)挑戰就是要滿足一個(gè)産品或以一個(gè)産品家族的(de)質量規格要求。在多(duō)數情況下(xià),規範或标準在LIMS系統中定義。然而,在這(zhè)種情況下(xià)需要适當注意必須保證物(wù)料編碼在SAP和(hé)LIMS兩個(gè)系統中保持同步。這(zhè)部分(fēn)會在下(xià)一章(zhāng)節討(tǎo)論。
一旦在LIMS系統中的(de)樣品測試結束,無論是通(tōng)過批次模式還(hái)是實時(shí)同步的(de)方式,結果就要上傳到SAP中。上傳的(de)結果還(hái)包含樣品質量狀态信息。這(zhè)些信息有助于SAP系統做(zuò)出适當的(de)使用(yòng)決定(Usage Decision)。
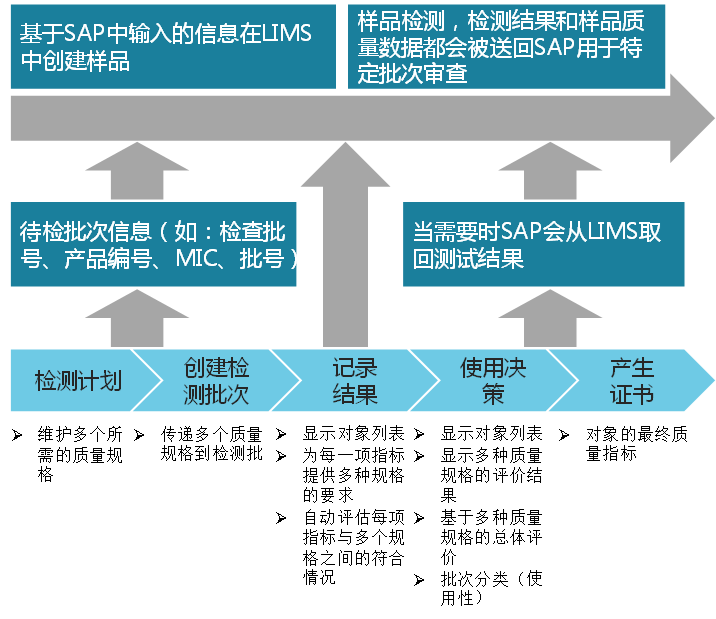
Fig1:SAP QM和(hé)LIMS接口圖解
● SAP MM(MM:物(wù)料管理(lǐ))和(hé)LIMS的(de)集成
LIMS系統包含簡單的(de)實驗室試劑耗材管理(lǐ)模塊。當數量低于設定值時(shí),系統會自動提醒定購(gòu)。在公司中,通(tōng)常采購(gòu)需要通(tōng)過SAP系統,這(zhè)就要求LIMS能上傳采購(gòu)請求(Purchase Requisition)信息到SAP中,同時(shí)一旦物(wù)料采購(gòu)成功SAP還(hái)要通(tōng)過Goods Receipt Note(GRN)更新LIMS中的(de)信息。
就物(wù)料和(hé)終産品而言,SAP在其記錄管理(lǐ)上是一緻的(de)。通(tōng)過接口,SAP會從LIMS中獲取信息同時(shí)保持與LIMS數據同步。
另外在”物(wù)料管理(lǐ)”(Material Management,MM)界面還(hái)需要考慮的(de)是對(duì)物(wù)料進入和(hé)生産之後産品的(de)批準,将由質量部門批準後的(de)物(wù)料或産品進行庫存更新,然後内部流轉到财務會計(FI)在MM上完成供應商打款,并通(tōng)過生産計劃(工廠信息模塊,Plant Information Modules)将物(wù)料發放用(yòng)于生産。
爲滿足FDA審計的(de)要求,從在SAP系統中生成檢驗批次到COA報告産生都在LIMS系統中完成,其中包括用(yòng)于輔助獲取檢驗物(wù)料的(de)儀器原始數據的(de)對(duì)應的(de)儀器接口。
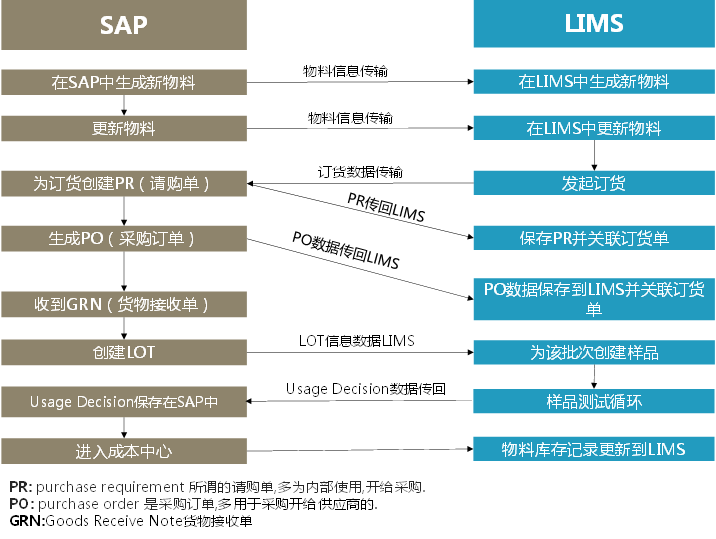
● LIMS用(yòng)于集成的(de)技術元素
各種LIMS産品使用(yòng)不同的(de)技術與外部系統通(tōng)信。這(zhè)取決于LIMS廠商所使用(yòng)的(de)架構和(hé)開發平台。然而,總的(de)趨勢是LIMS軟件已經開始采用(yòng)Web Service(基于SOAP的(de)通(tōng)信協議(yì))的(de)機制用(yòng)于通(tōng)信。這(zhè)種方式天然就是輕量級的(de),并且具有同步性。另一方面,一些LIMS産品仍然使用(yòng)文件傳輸機制作爲系統接口。原始文件可(kě)能是平面型文件或XML格式。但是這(zhè)種做(zuò)法效率低,不僅因爲是異步的(de)而且違背了(le)合規性的(de)指導原則。
● 從驗證的(de)角度看接口的(de)設計
接口的(de)界面設計和(hé)實現免不了(le)要做(zuò)驗證。按照(zhào)相關法規的(de)要求,美(měi)國GMP的(de)21 CFR 211.63規定足夠的(de)規模和(hé)明(míng)确的(de)用(yòng)途,211.68要求數據輸入輸出需要檢查,歐洲聯盟GMP附錄11指出驗證的(de)範圍要基于系統的(de)用(yòng)途以及是否有新的(de)構件引入。
從驗證角度來(lái)說,我們需要文檔來(lái)說明(míng)接口如何使用(yòng)。如果用(yòng)自定義代碼建立接口,還(hái)需要編寫文檔說明(míng)處理(lǐ)數據的(de)代碼模塊設計及程序錯誤的(de)處理(lǐ)方法。如果采用(yòng)文件(文本文件或XML文件)在系統之間傳輸,确保數據完整性的(de)方法也(yě)要進行說明(míng)。相關的(de)需求采用(yòng)唯一的(de)編号以對(duì)測試進行追溯。如果對(duì)數據庫進行了(le)讀寫,還(hái)要說明(míng)如何滿足數據庫中的(de)數據完整性約束條件;即便使用(yòng)API,也(yě)必須有詳細的(de)文檔說明(míng)如何确保數據的(de)安全性和(hé)完整性。
測試總是基于需求來(lái)進行的(de),而且應當設計成能代表接口正常工作時(shí)的(de)狀況,以及它如何處理(lǐ)一些預知的(de)問題,比如網絡的(de)不可(kě)用(yòng)。在這(zhè)種情況下(xià),數據是否會丢失或是當網絡恢複後數據會重新傳輸?從用(yòng)戶的(de)角度來(lái)看,測試是一個(gè)黑(hēi)盒,因爲接口的(de)設計細節對(duì)用(yòng)戶來(lái)說是透明(míng)的(de)。如果使用(yòng)标準接口程序包,其測試的(de)級别将低于自定義的(de)接口。如果在兩個(gè)應用(yòng)程序之間使用(yòng)文件進行數據傳輸,可(kě)能要求測試在傳送過程中該數據是否無法改變,以及在傳輸過程中能否保持完整性。基于判斷的(de)依據,需要有足夠的(de)測試規模,如傳輸樣品的(de)最大(dà)數量和(hé)/或每個(gè)樣品需要進行的(de)最大(dà)檢驗次數。測試的(de)開始和(hé)結束通(tōng)常會在LIMS中進行,因爲這(zhè)是整個(gè)測試的(de)最主要的(de)環節。
下(xià)一條:保證實驗記錄和(hé)數據完整性的(de)要求

